9. Химические свойства простых веществ: металлов и неметаллов.
1) интернет-уроки
УРОК-Химические свойства простых веществ металлов и неметаллов
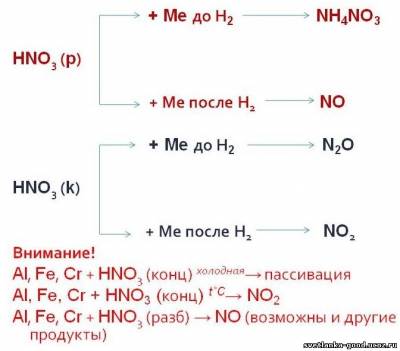
ОСОБОЕ ВНИМАНИЕ обратить на азотную и серную (конц и разбавл.) кислоты:
Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
ПРИМЕРЫ:
S + 6HNO3(конц) → H2SO4 + 6NO2 + 2H2O
B + 3HNO3 → H3BO3 + 3NO2
3P + 5HNO3 + 2H2O → 5NO + 3H3PO4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
Серная кислота + Ме
Взаимодействие серной кислоты с металлами: Н2SO4 (конц.) + Me = соль + H2O + Х
концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться доS+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2H2+6SO4 → Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 → 4Na2+1SO4 + H2S-2 + 4H2O
неМе + H2SO4(конц.) = H2O + SO2 + кислородсодержащая кислота неМе, (степень окисления неМе – высшая)
ПРИМЕРЫ:
C + 2H2SO4(конц) = 2H2O + CO2 + 2SO2
S +2H2SO4(конц) = 3SO2 + 2H2O
2P + 5H2SO4(конц) = 2H3PO4 + 5SO2 + 2H2O
ТРЕНАЖЕР свойства конц. серной кислоты.
ТРЕНАЖЕР Свойства концентрированной серной кислоты - взаимодействие с металлами.