к 16(23) декабря 9-В класс
Задание 2. Переписывая текст, вставьте пропущенные слова и подчеркните их одной чертой.
СТРОЕНИЕ атома АЗОТА (N).
Азот – типичный ………………….. элемент. Электронная формула: …………… Электронная схема строения атома азота……………..
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА.
Азот …………………. газ, не имеет ……………, мало …………. ………., немного легче …………., при …………. сжижается, а при -………. превращается в снегоподобную массу. Молекулярный азот …………………,т.к. между атомами в молекуле азота существует ……...связь.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА.
Азот химически ………………. Он не поддерживает ………………, ……………. При комнатной температуре реагирует только с …………... При взаимодействии азота с Ме образуются …………...
Mg +N2 → ? ; ? + N2 → AlN ; Ca + ? → Са3N2 ; Na + N2 → ?; ? + N2 → Zn3N2.
Большинство нитридов металлов используют как …………………..
Азот взаимодействует еще и с …………... Реакция с кислородом начинается при ………………. Уравнение: …………………………
ПОЛУЧЕНИЕ АЗОТА.
В промышленности азот получают……………………….
ПРИМЕНЕНИЕ АЗОТА.
Азот применяют для ……………………….., в ………………………, он используется как …………………….., например для заполнения ……………………., при перекачке.…………………, сушке …………………………………
к ....декабря
Внимательно прочитайте §22, выполните письменно №4, № 4 из § 23 легко выполните, если сначала рассмотрите и зарисуете рисунки 28,29, 32,33 - название рисунков необходимо.
§17-20 уметь ориентироваться в тексте учебника по теме "Соединения серы", знать химические формулы оксидов серы и соответствующих им кислот, формулу сероводорода, знать записи У.Э.
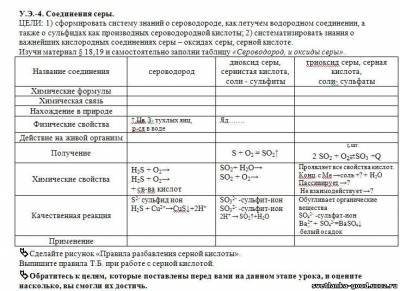
к .....декабря
§ 17 с.74- выводы знать
§ 18 №5 *, № 8,9
уметь писать химические реакции взаимодействия сероводорода с металлами, оксидами Ме и щелочами.
Тема: сероводород, сульфиды
к .... ноября
§12-14
У.Э.-2.1. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ.
Известно много химических реакций между металлами и неметаллами, в них неметаллы всегда выступают в роли окислителей (принимают электроны). В реакциях неметаллов между собой более электроотрицательный элемент (это тот элемент, которому меньше всего не хватает электронов до завершения внешнего энергетического уровня) является окислителем, менее электроотрицательный – восстановителем (отдает электроны).
Не отступая от текста учебника, заполни схему:

3. 2. ЗАДАНИЕ
Расставьте коэффициенты в химических уравнениях реакций:
1) Al + O2 → Al2O3
2) N2 + O2 → NO
3) C + O2 → CO2
3. ЗАДАНИЕ
Закончите уравнения химических реакций, укажите тип химической реакции (соединение, разложение, замещение, обмен) и назовите продукты реакций.
1. Сa + O2 →
2. Al + Cl2 →
3. Fe + S →
4. Mg + O2→
5. K + O2 →
к .... ноября
1) ЗАЧЕТ - кислоты, соли (8 класс)
2) определения - кислоты, соли, основания (9 класс)
| 








